从吉利德回应瑞德西韦专利争议谈药品专利强制许可
发布时间:2020-02-18
文 | 王函 合伙人 王则周 律师 汇业律师事务所
2月4日,在武汉病毒所公开声明申报了中国发明专利(抗2019新型冠状病毒的用途)后,吉利德公司全球CEO Daniel O’Day在2月5日的一场公司会议中回应了这场漩涡中的“专利争议”。
一位参会女性向DanielO’Day提问到,有报道称中国的武汉病毒所已经向中国的专利机构申报了瑞德西韦的专利,吉利德将如何应对武汉病毒所的专利申请,如果中国的专利机构批准了这一申请,吉利德会怎么维护自己的权益?
对此Daniel O’Day回答:刚刚昨晚上听说了这件事(武汉病毒研究所在中国抢注),我们现在是以最快的速度推进这个药的临床试用,在这里我想非常明确的对大家说,这件事,一点都不影响我们为世界卫生健康所作的努力,我们的责任是对病人负责,首先要确定通过医疗步骤,基于科学和临床来证明这个药是否对病人有效,同时也要加快这个药的生产,万一证明有效,可以尽量提供给全世界的病人。至于专利问题,我们现在不去考虑,我只说,像其它任何药物一样,专利不光是化学成分,也包括了所有的使用方法包括针对新冠肺炎病毒,这个药也一样适用于世界各地,但我们现在不会去抗议专利问题,我们总会找到帮助病人的方法。当然我们也会以独立的步骤来保护我们的知识产权,但现在我们把病人放在首要位置。
从这段话来看,吉利德表达了人道主义,一切以病人为优先。但有两个重要信息值得我们注意:
1. 吉利德表达了他们的专利保护非常完善,“包括了所有的使用方法包括针对新冠肺炎病毒,这个药也一样适用于世界各地”,不担心专利之争。
2. 吉利德表示:“至于专利问题,我们现在不去考虑”、“当然保护我们的知识产权作为一个独立的步骤”。吉利德现在不考虑,但并不代表将来不考虑,且会以独立的步骤来保护吉利德的知识产权。
2月8日,对此事及《中国科学报》提出的瑞德西韦生产成本与定价问题,吉利德科学(Gilead)公开回应表示,吉利德研发了瑞德西韦,并在美国、中国及世界其他地区拥有专利。2016年,针对瑞德西韦在冠状病毒上的应用,吉利德在中国以及全球申请了更多的专利。在中国,对于冠状病毒应用的专利申请尚待批准。
吉利德无权干涉专利局是否向中国研究人员授予专利。武汉病毒研究所的专利申请是在吉利德提交申请的三年多时间之后提交的,对这份申请的考量将会综合目前对于该合成药物已知的了解和正在申请中的专利。我们无法对研究人员专利申请的细节发表评论,因为专利申请内容在18个月之后才会公布。目前,我们关注的重点是尽快确定瑞德西韦治疗新型冠状病毒感染者的潜在安全性和有效性,并对未来潜在的供应需求加快生产进度。
此外,吉利德公司认为,现阶段讨论任何强制许可或其他类型许可还为时过早,他们并未与监管部门就吉利德的生产供应成本或财务回报进行过任何的讨论。
分析一下吉利德的专利就会发现,吉利德确实已经对化合物拥有较完备的全球专利保护。
吉利德公司针对瑞德西韦类似相关药物和针对病毒的治疗方法早就申请了PCT专利进行了全球专利布局,该PCT专利PCT/US2011/045102 于2011年7月22日申请,有57项同族专利申请,其中进入中国国家阶段的专利CN2011800357761“用于治疗副黏病毒科病毒感染的方法和化合物”于2015年11月25日授权,目前该专利处于有效维持状态。该专利的化合物结构使用马库什撰写方式,保护范围较宽,在治疗用途上也进行了比较上位的概括。权利要求21就是被保护的瑞德西韦的分子结构。该专利保护了化合物和治疗用途,属于基础专利和核心专利。
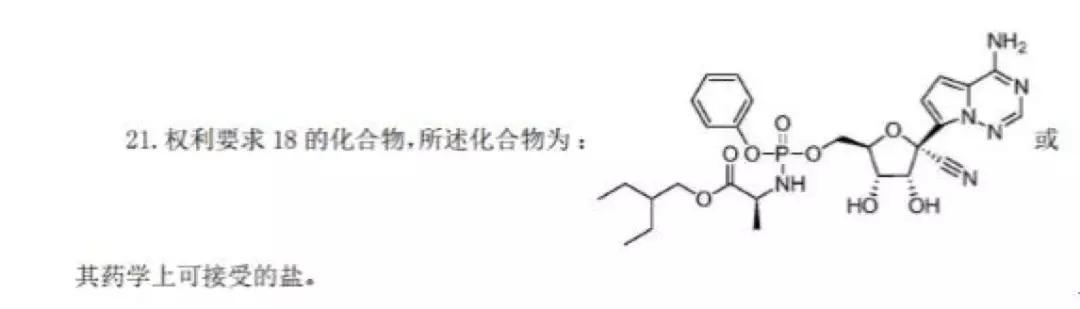
此外,吉利德已经将瑞德西韦用于治疗冠状病毒的用途申请了专利,专利申请号为CN2016800667968,发明名称为:治疗沙粒病毒科和冠状病毒科病毒感染的方法。该专利申请目前的法律状态是等待实审提案,该案于2018年8月8日进入实质审查阶段,尚未收到审查意见通知书,也并未授权。
根据武汉病毒研究所2月4日发布的信息,武汉病毒研究所在1月21日申报了中国发明专利(抗2019新型冠状病毒的用途)。关于武汉病毒所申请该专利授权的可能性分析详见作者发表的另一篇文章《武汉病毒所申请抗新冠病毒用途专利能否成功?》。笔者认为,武汉病毒所申请的瑞德西韦抗新冠病毒用途专利如果缺乏有效的对比实验数据来证明能带来预料不到的技术效果,很有可能因为不具备创造性而无法获得专利授权。武汉病毒所也可以利用优先权,在申请日起的1年内补充相关的对比试验数据来证明预料不到的技术效果。那么问题来了,如果武汉病毒所申请该专利最终获得授权,是否意味着武汉病毒所可以不经吉利德公司同意,独立使用新冠病毒的适应症专利呢?答案是否定的,由于吉利德已经有化合物和治疗用途专利,属于基础专利和核心专利。武汉所抗新冠病毒专利如能授权最多算是外围专利。要实施这个专利还必须获得吉利德的许可,因为这件专利并不具有独立性,要依赖基础专利的许可才能实施。将来如要将该化合物商业使用于新冠病毒适应症上,可能会涉及双方交叉许可,即武汉所需要经过吉利德许可使用化合物专利,而吉利德则需要经过武汉所许可使用新冠病毒适应症专利,互相交专利许可使用费。
这样就引发了一个相关问题,即在当前疫情下,是否需要考虑对吉利德的相关专利进行强制许可?接下来,我们就从新冠候选药瑞德西韦来谈谈专利强制许可。
一、药品专利强制许可制度介绍
药品专利强制许可,是专利强制许可制度的组成部分,是以药品为许可客体的强制许可,我国将药品专利强制许可定义为:国务院专利行政部门为了公共健康目的,对取得专利权的药品,可以给予制造并将其出口到符合条件的国家或者地区的强制许可。
要了解药品专利强制许可制度,要明确几个定义,首先药品包括什么?药品专利采用对药品的界定:“药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等”。值得注意的是,2019年2月1日,《国务院关于修改〈中华人民共和国专利法实施细则〉的决定》(以下简称《决定》)开始施行,《决定》中将取得“专利权的药品”界定为“解决公共健康问题所需的医药领域中的任何专利产品或者依照专利方法直接获得的产品”,包括取得专利权的制造该产品所需的活性成分以及使用该产品所需的诊断用品。这一修改意味着药物中间体、检测试剂盒等非传统概念的“药品”被纳入了药品专利强制许可制度的许可客体。
其次,要理解权利的行使的边界,即何种情况下可以实施药品专利强制许可。《专利法》第四十九条规定:在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可。第五十条:为了公共健康目的,对取得专利权的药品,国务院专利行政部门可以给予制造并将其出口到符合中华人民共和国参加的有关国际条约规定的国家或者地区的强制许可。同样值得注意的是,为了适应应对公共健康危机的需要,2019年2月1日开始施行《决定》对强制许可制度进行了修订:将实施强制许可的“未充分实施专利”的条件,界定为专利权人及其被许可人实施其专利的方式或者规模不能满足国内对专利产品或者专利方法的需求的情形。
最后,相关法条和如何实施以及后果。《专利法》第五十五条、第五十六条、第五十七条以及《专利法实施细则》第七十四条、第七十五条有相关规定。总结概括下来,在申请强制许可前,申请人应与专利权人协商,尽量取得自愿许可。在给予实施专利强制许可的决定后,应当登记和公告,限制许可的范围和时间,理由消除后作出终止实施强制许可的决定。取得实施强制许可的单位和个人不得独占实施权利,并无权允许他人实施,且为有偿使用。TRIPs协议第31 条规定各国可以“不实施”、“公共健康”、“国家安全”、 “依存专利“反竞争”等理由授予强制许可。另外需要注意的是,无论是TRIPs协议,还是其他国家的专利法,均非常强调在申请强制许可前申请人应与专利权人合理协商取得自愿许可的环节,并不认为这仅仅是程序性问题。
二、专利强制许可的经典案例(印度授予第一例药物专利强制许可)
我国迄今为止从未实施过药品专利的强制许可。但是我国的近邻,同样的人口大国印度,曾在2012年授予第一例药物专利强制许可。笔者就该案例进行一下详细的介绍。
1.案件背景
拜耳公司对药物化合物甲苯磺酸索拉非尼拥有专利权。索拉非尼被用来治疗晩期肾癌和肝癌,虽不能彻底治愈病人,但它的使用能延长晚期肝癌和肾癌病人的生命。2006年拜耳公司以商品名“多吉美”(Nexavar)在全世界推出其产品,在2007年收到了在印度进口和销售该药的许可证,2008年在印度推出该产品。同年,拜耳公司的索拉非尼在印度获得专利 (No.215758)。多吉美在印度的销售量保持在每月大约200人的剂量。印度病人服用多吉美1个月的药费大约需5600美元,相当于印度薪水最低工人3年半的工资。
Natco公司是印度的一家仿制药制造商。依照 Natco公司的统计,印度至少有100000名不同类型的肾癌和肝癌患者,此外,每年还有30000位新病人被诊断患有这两种疾病,并有将近24000位病人死亡。拜耳公司提供的该药物数量仅满足了印度2%的肾癌和肝癌病人的需要。Natco公司为此开发了制造索拉非尼所需的工艺,要求并获得了药监部门生产仿制药的许可,并向拜耳公司请求给予自愿许可,拜耳公司拒绝给予许可。于是Natco公司提出了强制许可申请。
2.交管过程
《印度专利法》第84条⑴规定:任何人都可以自专利授权之日起满3年后申请专利强制许可:①公众对该专利发明的合理要求未能得到满足;②公众无法以合理的可负担的价格获取该专利发明、③ 被授予专利的发明未能在印度领土上实施。Natco公司根据自己掌握的事实,对拜耳公司违反专利法规定应适用强制许可的理由进行了阐述:
首先,根据《印度专利法》的规定,Natco公司曾于2010年致信拜耳公司, 愿意以合理的条款和条件获得专利权人的自愿许可, 但收到了拜耳公司的拒绝信。Natco公司遂只能依法提起强制许可申请。
Natco公司在强制许可请求中列举事实表明,拜耳公司未能充分满足印度民众对其专利产品的需求,例如:拜耳公司仅通过进口提供药品,全国只有4个大城市的部分大医院附属药房才能获得数量的该药物;该药物价格过高,超出公众合理可负担范围等等。
Natco公司同时表明,将以低于拜耳公司97%的价格生产并销售专利药品多吉美,并表示会将该药品免费给予需要和符合条件的贫穷病人。
拜耳公司为自己作了积极辩护。拜耳公司声称作为药物的创新开发者,其有权决定什么是“适度和可负担的价格”,多吉美高昂的药费是基于创新的产品成本价格高于仿制药。并声称其所估计的应用该药治疗疾病的病人的数量少于强制许可申请中提到的数字。
经过权衡双方陈述的事实和理由,基于拜耳公司确实未能以可获得和可负担的标准为该药物定价,而且也不能保证该药物在印度有足够的和可持续的供应, 印度专利局局长于2012年3月9日作出授予Natco公司强制许可的决定。
该决定除认定专利权人(拜耳公司)没有采取任何适当或合理的步骤以足够的程度在印度领土上实施发明外,也对被许可人Natco公司生产索拉非尼药品施加了条件,包括:Natco 公司有权用其自己的生产设备制造该专利药,但是无权转包给其他公司生产;Natco公司必须支付净销售额的6%作为许可费,必须自己生产和仅在印度销售。根据该决定,Natco公司在2020年索拉非尼专利届满前,均可以在印度生产和销售索拉非尼产品。该药在印度的售价从而降低了 97%。拜耳公司不服该裁决决定,于2012年5月4日就该决定向位于钦奈的印度知识产权上诉委员会(IPAB) 提出了上诉。该上诉最终被驳回。
3.意义与启示
本强制许可决定具有里程碑式的意义,标志着《印度专利法》第一次允许当一种药物病人负担不起时,可生产仿制药,确保贫穷的病人也能获取该药物,同时仿制药生产商会向专利权人支付许可使用费,用以帮助专利权人补偿开发成本。
而迄今我国无一起强制许可申请和决定,即时在03年“非典”时期,也没有对奥司他韦实施强制许可,而是通过专利许可的方式授权东阳光生产销售。其主要原因是我国自身在不断加强医药方面知识产权保护,如果贸然使用专利强制许可,将打击国际社会对中国IP保护的信心。所以在自身需求和国际舆论的双重压力下,我国在本问题上一直采取谨慎态度。
三、是否需要对瑞德西韦实施专利强制许可?
1.瑞德西韦(Remdesivir)目前的使用情况
对于新型冠状病毒感染的肺炎,目前国家卫生健康委《新型冠状病毒感染的肺炎诊疗方案(试行第三版)》中推荐的治疗方式是使用利托那韦/洛匹那韦。但是根据最新的研究数据,一款名为瑞德西韦(Remdesivir)的新型核苷类似物抗病毒药,可能是最具潜力的候选抗新型冠状病毒药物。该款药物由吉利德(Gilead)公司研发,通过对人肺上皮细胞进行冠状病毒培养,发现瑞德西韦(Remdesivir)具有强效的抗病毒疗效,对于MERS-CoV和SARS-CoV,其半数有效浓度(EC50)均为0.07μM,相比之下,利托那韦/洛匹那韦对于MERS-CoV和SARS-CoV的EC50值分别为8μM和17μM。网上也出现了“吉利德专利被美国总统特朗普豁免提供给中国仿制”等说法,已被证实为虚假信息。根据两家美国媒体的报道,“瑞德西韦”这个药物目前并未在美国或全世界任何一个国家获批上市,其疗效和安全性也并未被严格确认,只能依照美国的法规进行“同情使用”,即当病人缺乏有效的疗法时,可以用这种尚未得到批准上市的药物来尝试是否管用。据悉,2月5日,瑞德西韦三期临床试验正式在武汉启动:入组患者761例。试验数据尚未公布,药物在治疗新型冠状病毒肺炎上的有效性尚待试验论证。
由此可见,瑞德西韦目前并不是可以商业化使用的药品,其疗效和毒副作用还有待临床试验数据的验证和确认。一款新药从研发到上市通常需要经过以下过程(一般需10年以上):一、临床前研究:1、实验室研究开发(一般2-3年);2、临床前实验(一般 2-4年),包括药理学研究、毒理学研究、制剂的开发。二、临床试验审批;三、临床试验(一般3-7年);人体试验共分三期:Ⅰ期临床 20-100例,正常人,主要进行安全性评价;Ⅱ期临床 100-300例,病人,主要进行有效性评价;Ⅲ期临床 300-5000例,病人,扩大样本量,进一步评价。四、新药上市审批。在疫情特殊时期,瑞德西韦有可能会通过快速通道上市。笔者认为,在瑞德西韦目前还只是候选药物,临床试验才刚开始的情况下,去讨论和实施专利强制许可为时尚早。
2.专利问题
吉利德关于瑞德西韦用于治疗冠状病毒的用途的专利申请CN2016800667968尚未授权,武汉所抗新冠病毒专利申请才刚申请尚未授权。没有被授权的专利不存在被强制许可的基础。笔者在文章《武汉病毒所申请抗新冠病毒用途专利能否成功?》中提出吉利德CN2016800667968专利申请未必能获得抗所有冠状病毒用途的宽保护范围授权的观点。对于这两个专利申请的后续进展,我们将保持关注。
武汉病毒所申请该专利被网上备受争议,其实从专业的角度分析,是有其积极意义的。首先,它可能会导致交叉许可,让中国在与吉利德谈判许可费用时拥有更多的主动权和谈判筹码。此外,退一步讲,武汉病毒所申请该专利即使最终无法授权,该专利申请进入公知领域,吉利德也无法在使用治疗新冠病毒肺炎上获取更多的利益,意味着中国将节省巨大的医疗开支。综上,武汉病毒所申请专利的举动其实意味着中国对知识产权保护的意识在不断增强,中国官方对疾病治疗非常重视。
试想,如果武汉病毒所不申请该专利会有怎样的后果?那么吉利德将有极大概率会申请该专利。假如吉利德去申请该专利且授权。吉利德将完全掌握针对该专利自愿许可谈判的主导权,那么中国在应对本次突发公共卫生危机时可能采取专利强制许可。但专利强制许可不等于免费,中国既要出钱,还有可能在国际上遭受巨大舆论压力,面对“中国很霸道”,“中国市场不安全”等等负面报道。所以中国想要避免使用专利强制许可,因为它一直在努力表明中国尊重知识产权,而滥用强制许可将招致国际批评。
彭博社(Bloomberg)指出,“中国目前决定申请专利,而不是采取强制许可,这凸显出中国想在遏制病毒爆发的同时,维持其对保护知识产权的承诺。”可以看出,此次中国在应对公共卫生危机的同时兼顾权利人知识产权,获得了国际社会舆论的认可。








