开启中国医药新纪元——中美欧日比较法视角下简评新《专利法实施细则》修改对中国药品专利期限补偿制度PTE的影响
发布时间:2024-03-11
文 | 唐嘉伟 王玉倩 汇业律师事务所

2023年12月21日,国务院发布国令第769号,《中华人民共和国专利法实施细则(2023年修订)》落地(以下简称“《专利法实施细则》(2023修订)”)。新《专利法实施细则》(2023修订)于2024年1月20日起正式运转施行。新《专利法实施细则》(2023修订)距离2010年1月9日修改的《专利法实施细则》已有近十四年之久,其是适应2020年10月17日通过的《中华人民共和国专利法》(2020修订)的第四次修正而进行的全面修改,具有重大意义。中国国家知识产权局同时相应地发布了配套修改的《专利审查指南》(2023)、《关于施行修改后的专利法及其实施细则相关审查业务处理过渡办法的公告(第559号)》、《关于专利权期限补偿和专利开放许可相关行政复议事项的公告》等配套性文件和规章,以保障修改后的实施细则的顺利实施。本次专利法实施细则修改涉及专利制度的诸多方面以及众多条款。对中国医药界而言,最重大的变革点以及关注点当属中国药品专利期限补偿制度PTE的整体框架和思路基本确定和形成。
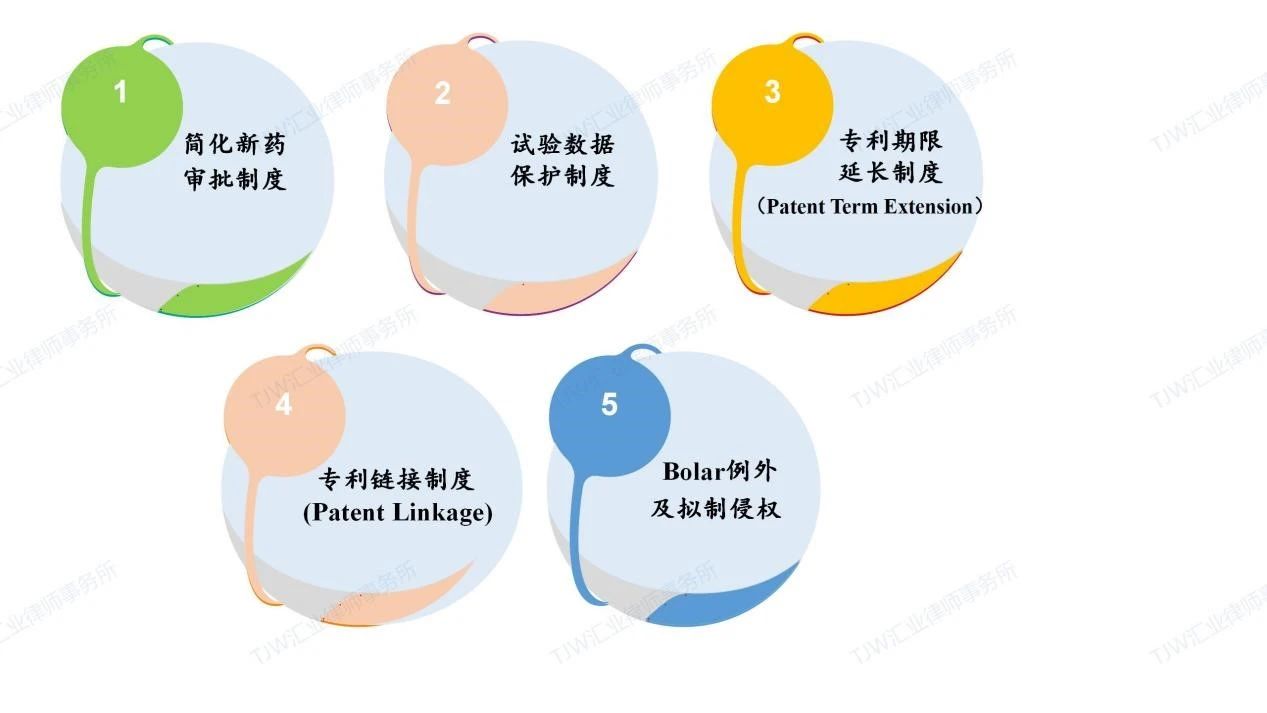
药品专利期限补偿制度又称药品专利期限延长制度,英文为Patent Term Extension,简称为PTE,其起源于美国1984年的《药品价格竞争与专利期补偿法案》,即Hatch-Waxman法案[1]。Hatch-Waxman法案中与药品审批及药品专利相关的主要制度包括(请见如下图1):简化新药审批制度、试验数据保护制度、专利期限延长制度(PTE)、专利链接制度(Patent Linkage)[2]、Bolar例外制度及拟制侵权制度。
图1 Hatch-Waxman法案中与药品审批及药品专利相关的主要制度
本文将在中美欧日比较法视角下,参考美国、欧盟和日本的药品专利期限补偿制度,并结合中国现行《专利法》、新修订的《专利法实施细则》、《专利审查指南》等对我国的药品专利期限补偿制度PTE进行简析,以期为众多生物医药企业的专利布局和药品申报策略提供参考。
一、中国药品专利期限补偿制度PTE立法动态概述及新修改
2017年, 我国发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出:开展药品专利期限补偿制度试点。选择部分新药开展试点,对因临床试验和审评审批延误上市的时间,给予适当专利期限补偿。
2020年中美双方签订的《中华人民共和国政府和美利坚合众国政府经济贸易协议》,作为药品知识产权保护的一环,我国对关于建立包括专利有效期延长/专利期限补偿制度在内的药品专利的早期纠纷解决机制作出了承诺。
现行《中华人民共和国专利法(2020修正)》于2021年6月1日生效,其第四十二条第三款规定:“为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。”对中国药品专利期限补偿制度做出了原则性安排,自此,我国开始开启建立中国药品专利期限补偿制度的篇章。
为了进一步配套中国药品专利期限补偿制度的具体实施细则,中国国家知识产权局分别在2020年11月27日公布《专利法实施细则修改建议(征求意见稿)》以及在2021年8月3日公布《专利审查指南修改草案(征求意见稿)》,对早期专利纠纷解决机制同时做出了对应性规定,涉及专利药品保护期延长计算(中国药品专利期限补偿制度)、新药定义,以及链接制度细节规范。(1)根据《专利法实施细则(征求意见稿)》第八十五条之四款的规定,从而进一步明确了《专利法》第四十二条第三款中所说的适用于中国药品专利期限补偿制度的“新药”为“化学药、生物制品和中药新药”,但是《专利法》和《专利法实施细则(征求意见稿)》均没有明确说明“新药”的概念和范围。(2)根据《专利审查指南(征求意见稿)》第五部分第九章第3.4节规定,进一步建议中国药品专利期限补偿对象为:1类创新药;2.1类化药(盐或酯),2.2类生物制品(疫苗菌毒种改进,新适应症),2.3类中药,2.4类化药;排除之前有争议的第5类(境外上市的原研药品和改良型药品申请在境内上市)。
2023年12月21日发布的新《专利法实施细则》(2023修订)及同日发布的《专利审查指南》(2023),使得中国药品专利期限补偿制度PTE的整体框架和思路基本确定和形成,至此,关于药品专利权期限补偿的各项规定已经确定,基于文章篇幅考虑,本文将主要针对中国药品专利期限补偿制度PTE的如下关键性问题进行论述:
(一)PatentType:明确可能适用的药品专利类型,限定PTE的适用对象
新《专利法实施细则》(2023修订)新增第八十条,明确了药品专利期限补偿制度PTE的发明专利类型。根据新《专利法实施细则》(2023修订)第八十条规定,新药相关发明专利是指符合规定的新药产品专利、制备方法专利、医药用途专利,因此可见,并非任何与新药相关的专利均可进行药品专利期限补偿PTE,新《专利法实施细则》(2023修订)将可申请适用药品专利期限补偿PTE的制度的新药发明专利类型最终限定为产品、制备方法和医药用途。
以小分子化学药为例,小分子化药的研发历经靶点选择、先导化合物确定、活性化合物筛选、候选药物选定、制备路线优化以及药物制剂的开发等过程,这使得化学药专利布局具有一定的难度和专业性,小分子化药涉及的专利类型通常涉及通式化合物及衍生物、药学上可接受的盐、晶型、游离酸/碱、异构体、代谢物、中间体、生产工艺及制备方法、联合用药、适应症/用途等。以示说明,我们从中国药品专利期限补偿制度PTE相关不同发明专利类型的角度简要列举了百济神州代表性药品泽布替尼典型专利ZL201480003692.3(作为蛋白质激酶抑制剂的稠合杂环化合物)的相关权利要求哪些属于产品专利类型,哪些属于医药用途发明专利类型,以及是否存在制备方法发明专利类型,具体请见如下图2。
图2 中国药品专利期限补偿制度PTE相关新药发明专利类型

关于PTE适用的专利类型,建议并提醒广大生物医药企业关注PTE制度中的产品(组合物)和医药用途是否可以涵盖“晶型用途/晶型组合物专利”
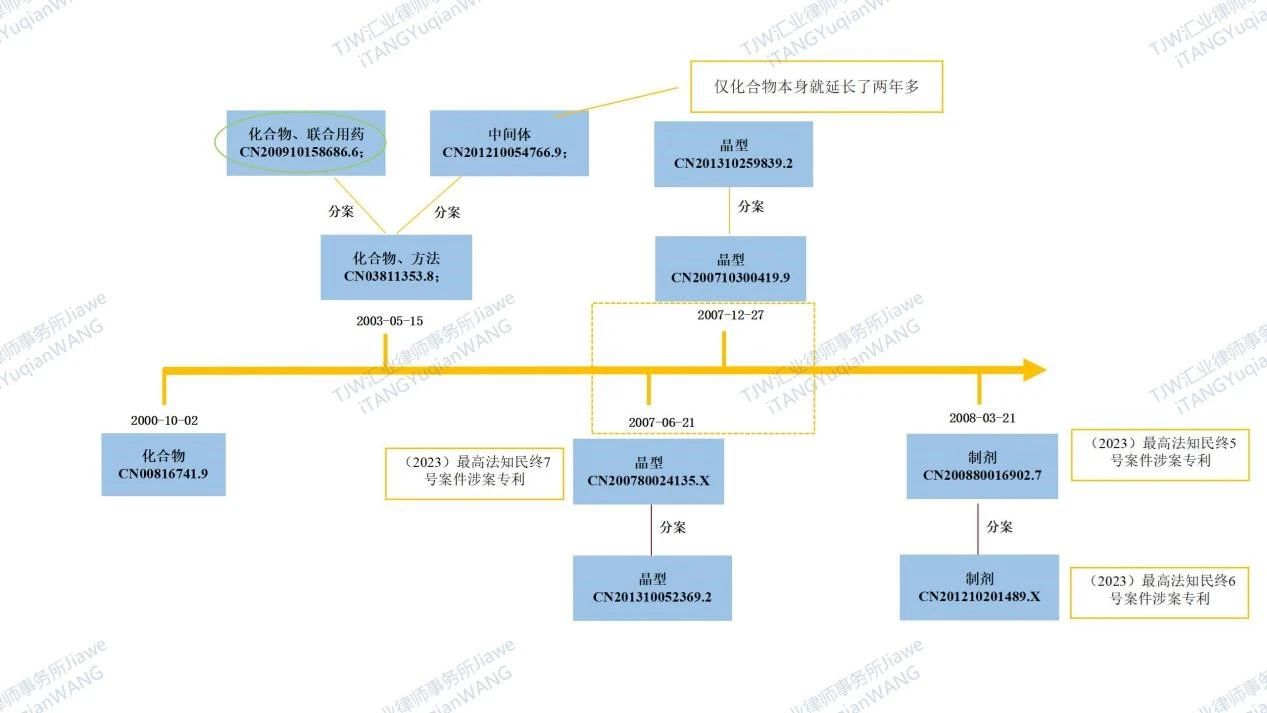
阿斯利康的小分子重磅药物达格列净是百时美施贵宝开发后转让给阿斯利康的一款口服降糖药,其中国部分专利布局请见如下图3。2023年6月14日,最高人民法院知识产权庭就阿斯利康与四川国为阿斯利康重磅药物达格列净三起专利链接纠纷案件(2023)最高法知民终5号、6号、7号)同日作出终审裁判,其中(2023)最高法知民终5号案件涉及达格列净的制剂专利ZL200880016902.7,(2023)最高法知民终6号案件涉及达格列净的制剂专利ZL201210201489.X,(2023)最高法知民终7号案件涉及达格列净的晶型专利ZL200780024135.X。在(2023)最高法知民终7号案件中,最高人民法院认为晶型用途/晶型组合物专利不应纳入药品专利链接体系中:药品专利链接制度可登记的专利类型应为药物活性成分化合物专利、含活性成分的药物组合物专利及前两者的医药用途专利;而且,在已有的以分子结构表达的化合物基础上进一步以晶体晶胞参数和空间群、晶体XRPD图(数据)、固相NMR图(数据)等特征表征结晶结构的化合物专利以及包含该化合物的组合物专利不应包括在药品专利纠纷实施办法规定的药物活性成分化合物专利、含活性成分的药物组合物专利的范围内。
虽然药品专利链接制度Patent Linkage中的药品专利登记标准与药品专利期限补偿制度PTE中的药品专利适格标准相对独立,但考虑到达格列净晶型案中最高人民法院知识产权庭的态度,中国药品专利期限补偿制度PTE中的产品(组合物)和医药用途是否可以涵盖“晶型用途/晶型组合物专利”,是中国生物医药行业时刻关注及实践中亟待解决的尚未有结论的问题之一。
图3 化学药-阿斯利康小分子重磅药物达格列净中国部分专利布局
(二)New Drug:厘清中国药品专利补偿制度PTE“新药相关发明专利”中“新药”的概念及内涵
作为行政法规,新《专利法实施细则》(2023修订)并没有明确说明“新药相关发明专利”中“新药”的概念和范围,关于能够获得中国药品专利权期限补偿的“新药”应该采用何种标准,是指“全球新”还是“中国新”并没有给出明确答案,其中“全球新”是指药品在境内外均未上市,“中国新”是指药品未曾在中国境内上市。
作为提供具体问题实操指导的部门规章,根据配套实施生效的《专利审查指南》(2023)第五部分第九章第3.4节的规定,中国药品专利期限补偿制度PTE中的“新药”仅指国务院药品监督管理部门(即国家药品监督管理局,National Medical Products Administration,简称NMPA))批准上市的创新药和符合本章规定的改良型新药,对于其中药物活性物质的产品发明专利、制备方法发明专利或者医药用途发明专利,可以给予药品专利权期限补偿,包括化学药、生物制品和中药。根据中国药品注册分类标准,中国药品专利期限补偿制度PTE中的“新药”已经排除了之前有争议的化学药第5.1类(境外上市的原研药品和改良型药品申请在境内上市)。一定程度上,可见中国药品专利期限补偿制度PTE中的“新药”仅指NMPA批准上市的属于“全球新”的创新药和部分改良型新药,具体包括:1类创新药;2.1类化药(盐或酯),2.2类生物制品(疫苗菌毒种改进,新适应症),2.3类中药,2.4类化药;排除之前有争议的第5.1类。
化学药品
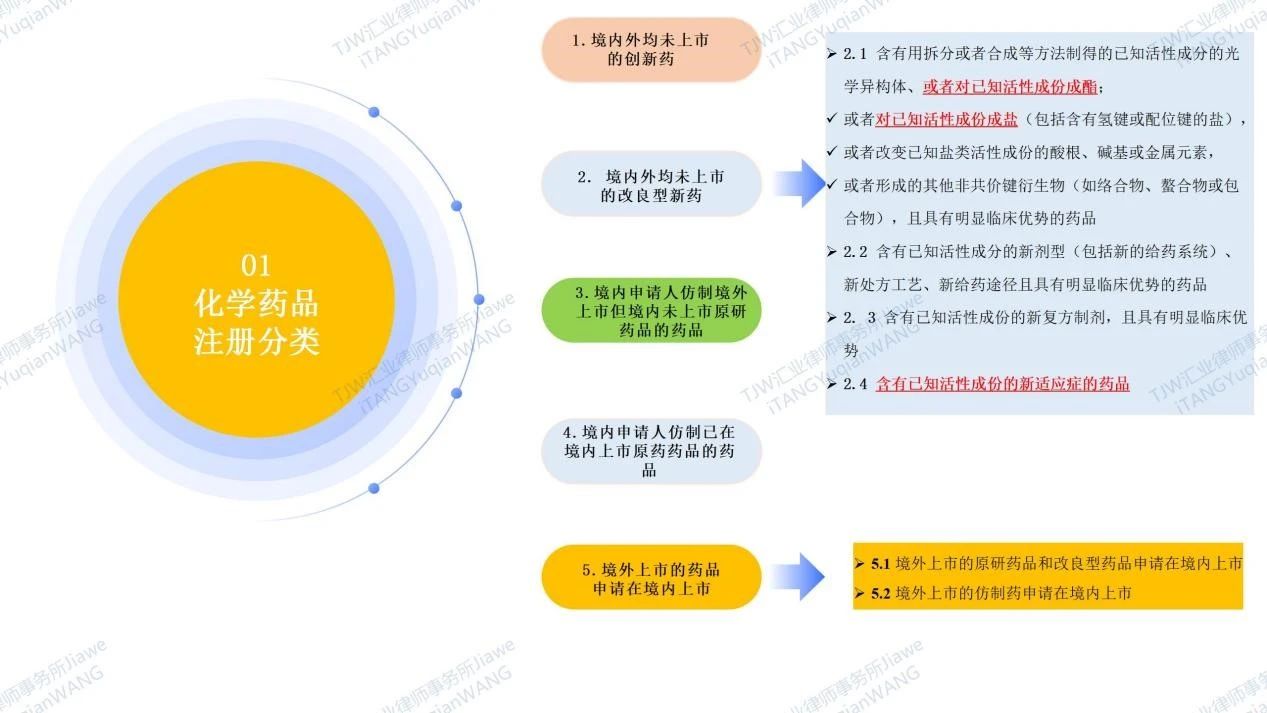
是指通过化学合成的方式生产的药物;分子量较低,也叫小分子药。根据NMPA于2020年6月29日发布的现行有效的《化学药品注册分类及申报资料要求》及于2020年01月22日发布的现行有效《药品注册管理办法(2020)》,我国的化学药品注册分类包括创新药、改良型新药、仿制药(境内申请人仿制境外上市但境内未上市原研药品的药品、境内申请人仿制已在境内上市原药药品的药品)、境外已上市境内未上市化学药品(具体请见如下图4)。可见中国药品专利期限补偿制度PTE中的“新药”,在化学药品领域,创新药包括1类境内外均未上市的化学创新药,部分改良型新药包括2.1类境内外均未上市的改良型新药(已知活性成分的盐或酯),2.4类境内外均未上市的改良型新药(含有已知活性成份的新适应症的药品)。
图4 化学药品注册分类
中药
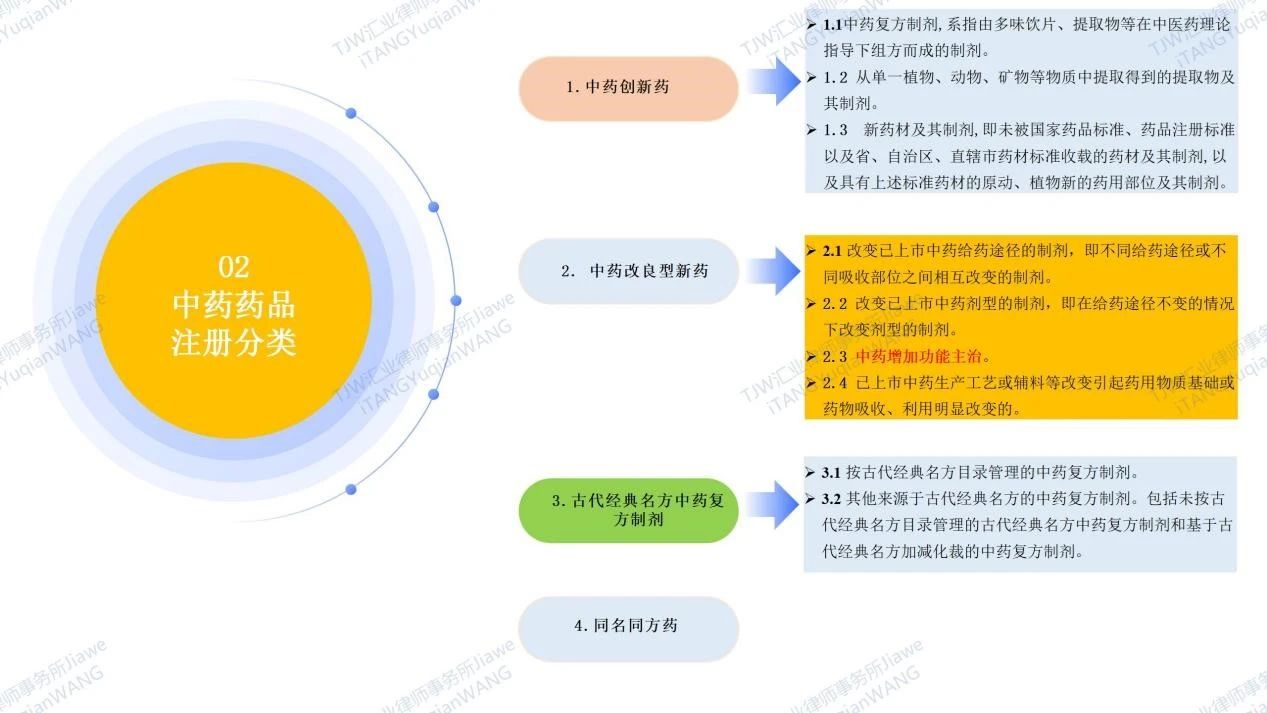
是指中医理论指导下用于预防治疗诊断疾病的药物。根据NMPA于2020年9月28日发布的《中药注册分类及申报资料要求》及于2020年01月22日发布的现行有效《药品注册管理办法(2020)》,我国的中药药品注册分类包括中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药(具体请见如下图5)。可见中国药品专利期限补偿制度PTE中的“新药”,在中药药品领域,创新药包括1类中药创新药,部分改良型新药包括2.3类中药改良型新药(中药增加功能主治)。
图5 中药药品注册分类
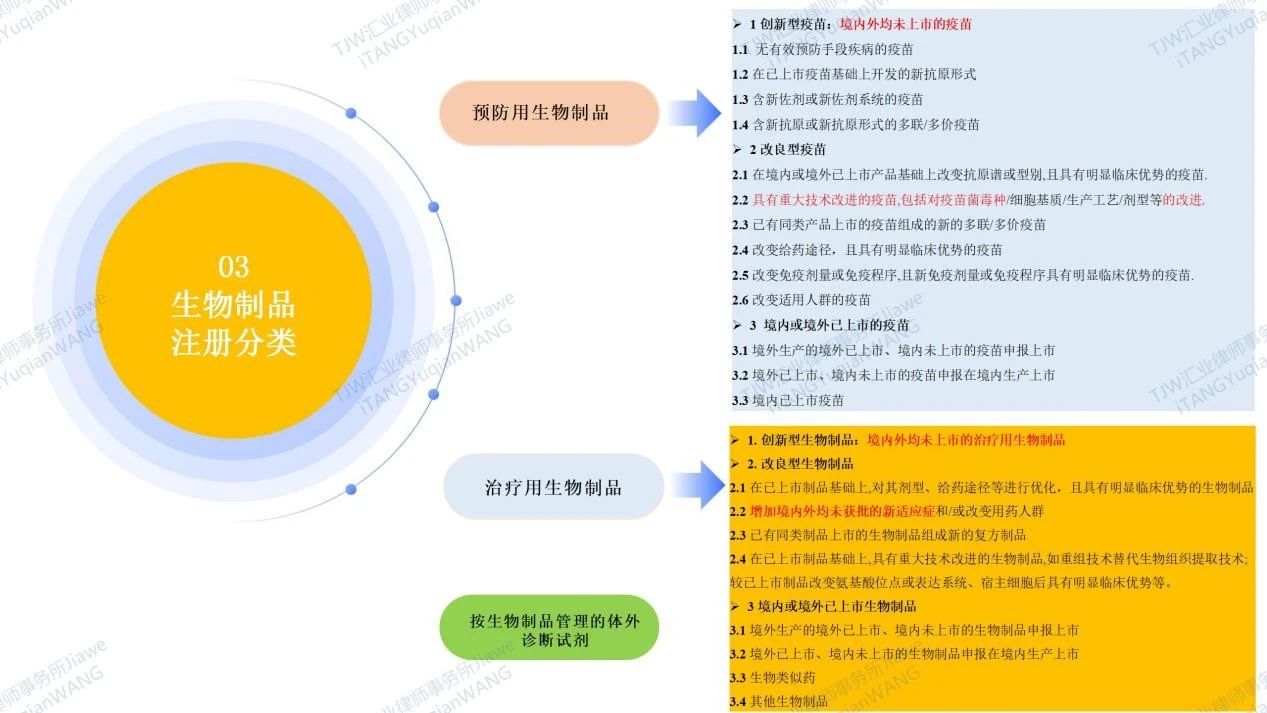
生物制品
是指通过细胞或生物体生物合成方式生产的药物;高分子量;亦叫大分子药。根据NMPA于2020年6月29日发布的现行有效的《生物制品注册分类及申报资料要求》及于2020年01月22日发布的现行有效《药品注册管理办法(2020)》,我国的生物制品注册分类包括预防用生物制品、治疗用生物制品两个大类以及按生物制品管理的体外诊断试剂,共计三类(具体请见如下图6)。可见中国药品专利期限补偿制度PTE中的“新药”,在生物制品领域,创新药包括1类:创新型疫苗:境内外均未上市的疫苗,1类:创新型生物制品:境内外均未上市的治疗用生物制品;部分改良型新药包括预防用生物制品2.2类中对疫苗菌毒种改进的疫苗,治疗用生物制品第2.2类中增加新适应症的生物制品。
图6 生物制品注册分类
(三)中国药品专利补偿期限PTE的计算方法及确定
根据现行《专利法(2020修正)》第四十二条第三款的规定“为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年”。新《专利法实施细则》(2023修订)第82条规定了具体PTE补偿期限的计算方法如下:“依照专利法第四十二条第三款的规定给予专利权期限补偿的,补偿期限按照该专利申请日至该新药在中国获得上市许可之日的间隔天数减去5年,在符合专利法第四十二条第三款规定的基础上确定”。
相较于2020年11月27日公布的《专利法实施细则修改建议(征求意见稿)》第八十五条之七的规定,本次新《专利法实施细则》(2023修订)删掉了原来《专利法实施细则修改建议(征求意见稿)》第八十五条之七中规定的第四款“专利期限剩余6个月以上”的限制,只是将“专利还在有效期内”的兜底条件合并入原来《专利法实施细则修改建议(征求意见稿)》第八十五条之七中规定的第三款。关于中国药品专利期限补偿制度PTE的计算方式和流程图以及注意点总结如下:
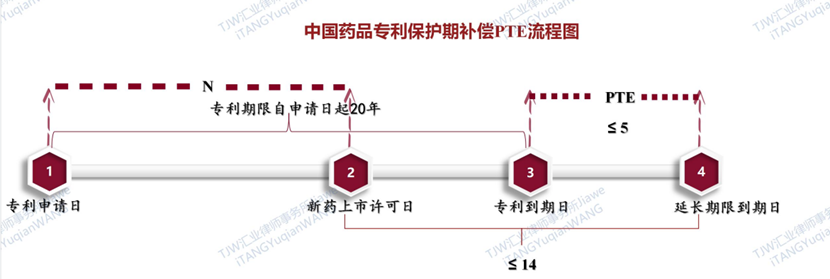
新药上市许可日和专利申请日间隔短于6年的,不再涉及补偿
新药上市许可日和专利申请日间隔11年及更长的,可以得到最长5年的补偿
越是剩余专利期短,补偿的意义越大
(四)中国药品专利补偿期限PTE的限定条件和要求
根据新《专利法实施细则》(2023修订)第八十一条、配套实施生效的《专利审查指南》(2023)第五部分第九章第3.1节,请求中国药品专利补偿期限PTE应当满足以下条件:

注:新《专利法实施细则》(2023修订)以及配套实施生效的《专利审查指南》(2023)删除了“请求给予药品专利期限补偿的专利剩余保护期限不少于6个月”的内容。
二、美国、欧盟、日本、中国的药品专利期限补偿制度比较
(一)美国专利期限补偿/延长制度 (Patent Term Extension)
(1) 美国药品专利期限补偿PTE的限定条件和要求(35 U.S.C.§156)[3]
美国的药品专利期限补偿PTE制度主要规定在《美国法典》第35编第156条(35 U.S.C.§156),根据第156条(35 U.S.C.§156)中对PTE制度的规定,对美国药品专利期限补偿PTE的限定条件和要求初步总结如下:

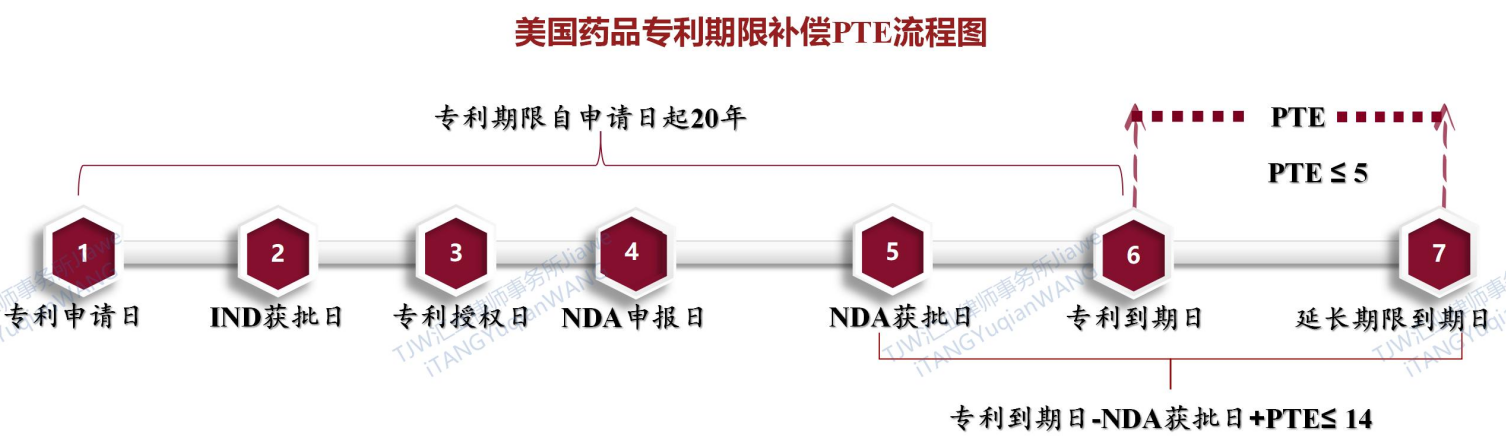
美国药品专利期限补偿时间PTE=(NDA获批的总时间 -专利授权日前NDA审批的时间-专利权人未尽到合理注意义务延误的时间)+(临床试验的总时间-专利授权日前临床试验的时间)×1/2
美国药品专利期限补偿时间PTE ≈ ½(临床试验阶段)+ 批准阶段
(3) 美国药品专利期限补偿制度PTE典型案例-立普妥(Lipitor,阿托伐他汀钙片)
重磅小分子化药立普妥(英文商品名为Lipitor,通用名为阿托伐他汀钙片)是由华纳兰比特Warner-Lambert研发,后与辉瑞公司Pfizer合作推广的全球第5个上市的他汀类药物,其化学结构式为
立普妥于1996年12月17日经FDA(美国食品药品监督管,U.S. Food and Drug Administration)批准上市,2004年成为全球第一个年销售额超过100亿美元的超级重磅炸弹药物。经在美国橙皮书(FDA-Orange Book)[4]对立普妥相关专利登记进行检索,其化合物基础专利US4681893(专利名称为Trans-6-[2-(3- or 4-carboxamido-substituted pyrrol-1-yl)alkyl]-4-hydroxypyran-2-one inhibitors of cholesterol synthesis)申请了美国PTE延长。如下图为立普妥在美国专利(US4681893)申请到上市的时间线作为计算基准的PTE时间节点。
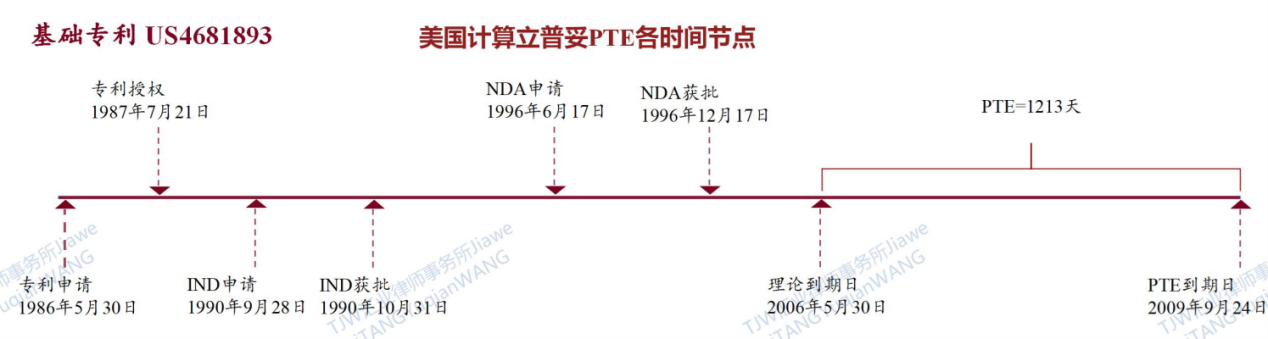
立普妥化合物基础专利US4681893在美国橙皮书登记专利类型为物质专利、产品专利,专利用途代码为U-161。其延长时间不满5年,并且从NDA获批之日起计算至专利延长期结束,不满14年;因此经审批,该基础专利(US4681893)获得1213天的专利延长期,延长至2009年9月24日。此处需要提醒,由于生产商完成一次儿科临床试验,FDA给予了立普妥药品额外6个月的试验数据保护期。
(二)欧盟补充保证书制度(Supplementary Protection Certificates,SPC)
(1)欧盟补充保证书制度SPC的限定条件和要求(469/2009/EC)[5]
欧盟的补充保证书制度SPC主要规定在欧盟469/2009/EC指令中,根据469/2009/EC指令第3、7、8、9、10、13、14、36等条款中对SPC制度的规定,对欧盟补充保证书制度SPC的限定条件和要求初步总结如下:

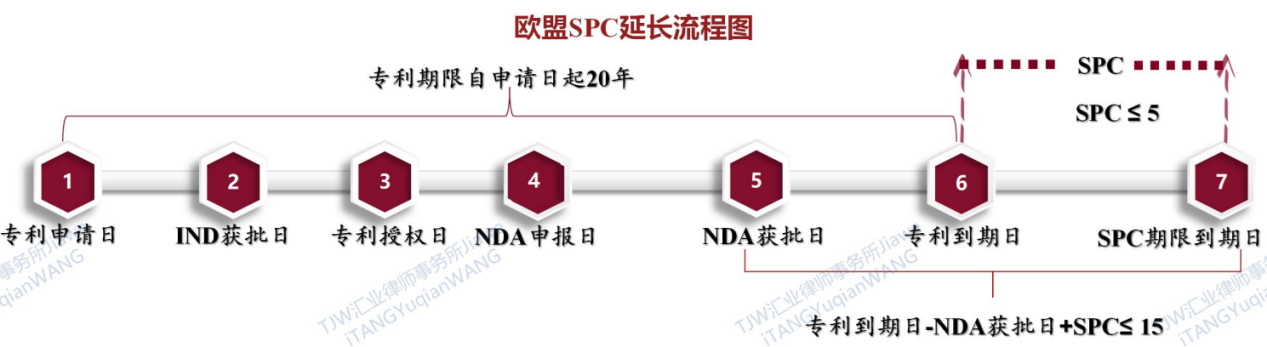
SPC应在基本专利的有效期限届满后生效,从提出基本专利申请之日到将该产品投放到共同体市场的首次获批之间的时间减去5年,但自基本专利期届满之日起最长5年,且药品通过批准后剩余的基本专利期加上补充保护证书的有效期不得超过15年。
(三)日本专利期限补偿/延长制度 (Patent Term Extension)
(1) 日本药品专利期限补偿PTE的限定条件和要求(日本专利法第67、68条)[6]
日本的药品专利期限补偿PTE制度主要法律依据规定在《日本专利法》第67、68条(注:日本专利法,又译作特许法),同时《日本专利法实施细则》(又称《日本特许法施行令》)对日本药品专利期限补偿PTE制度进行了细化。根据《日本专利法》及《日本专利法实施细则》中对PTE制度的规定,对日本药品专利期限补偿PTE的限定条件和要求初步总结如下:

(2) 日本药品专利期限补偿制度PTE的计算方式和流程图以及注意点总结
专利授权日>IND获批日,日本药品专利补偿期限PTE = NDA获批日-专利授权日
专利授权日<IND获批日,日本药品专利补偿期限PTE = NDA获批日-IND获批日
(四)美、中、欧、日药品专利期限补偿/延长制度对比
通过如上对中国、美国、欧盟、日本相关药品专利期限补偿制度相关规定以及限定条件和要求的初步阐释,请见下图对美、中、欧、日药品专利期限补偿/延长制度对比的初步归纳及分析:
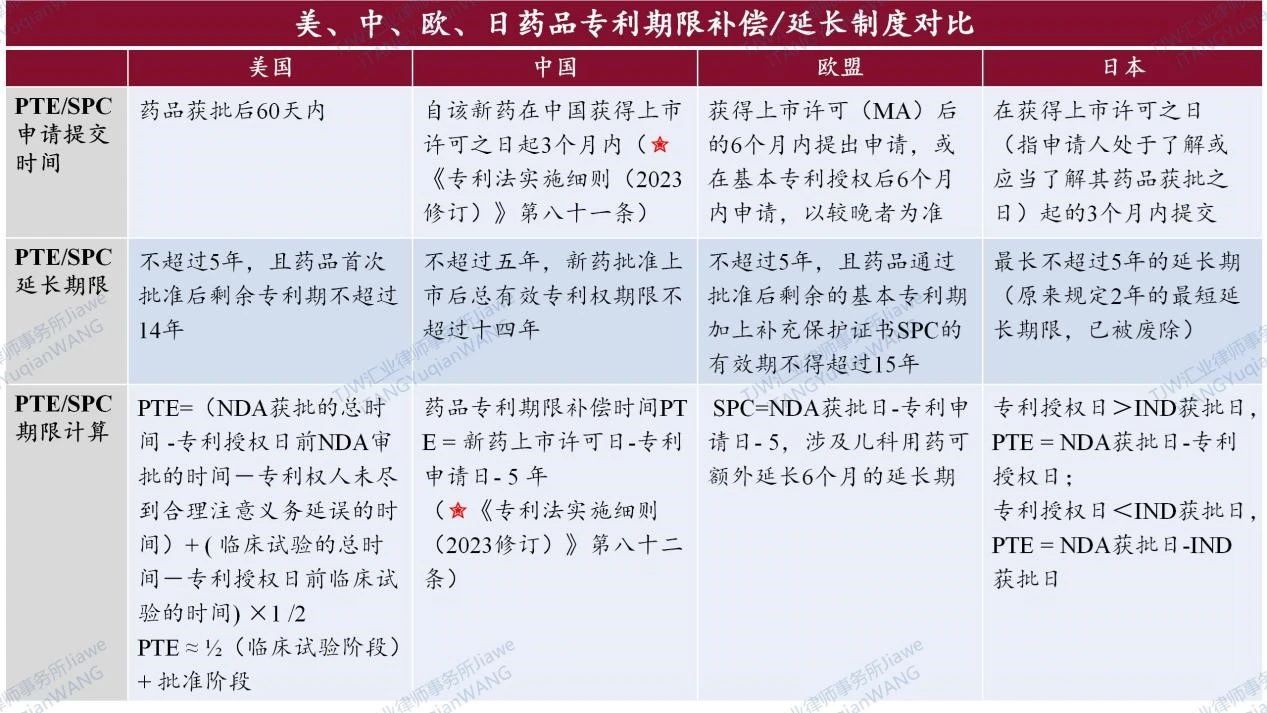
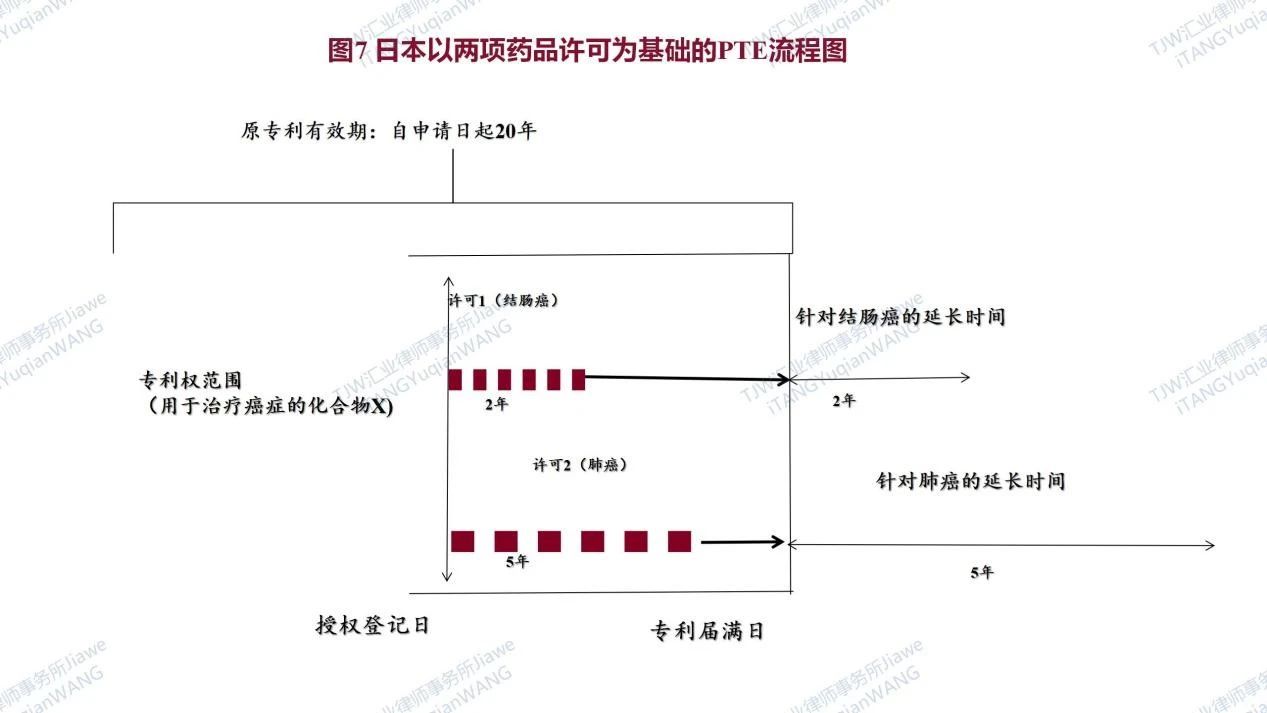
总结来说,通过在中美欧日比较法视角下,参考美国、欧盟和日本的药品专利期限补偿制度,并结合中国现行《专利法》、新修订的《专利法实施细则》、《专利审查指南》等对我国的药品专利期限补偿制度PTE进行简析,中国的药品专利期限补偿制度PTE一定程度吸收或借鉴了美国的药品专利期限补偿PTE制度和欧盟的药品补充保证书SPC制度的经验:比如(1)中国药品专利期限补偿制度PTE同样规定了最长的补偿期限(5年)和药品上市后专利的最长剩余期限(14年),并且对同一专利或同一药品的期限补偿进行了限制;(2)中国的药品专利期限补偿制度PTE与欧盟药品补充保证书制度SPC在计算方法上具有一致性,均是基于新药上市许可/获批日和专利申请日来计算专利的补偿期限PTE或SPC;(3)但需要特别指出,中国的药品专利期限补偿制度也根据我国的国情进行了调整:比如美国中国及欧盟对同一药品或同一专利进行了限定,但日本却和美国中国及欧盟完全不同,在日本每一项规定的药品批准可以多次延长多项专利(延长期不累加),即一件药品专利的期限可以基于多件药品上市许可而被延长多次,而多件相关专利的期限也可以基于同一件药品上市许可而均获得延长,以做示例说明,请见如下图7为日本以两项药品许可为基础的PTE流程图[7];再比如,如前所述,针对此前有争议的第5.1类在中国申报上市之前已在国外上市的药品不能在中国获得药品专利期限补偿,这也有利于鼓励原研药企业在中国积极进行临床试验以及申报药品上市。
三、开启中国医药新纪元-中国药品专利期限补偿制度PTE总结、展望及建议
随着新修订的《专利法实施细则》正式落地、以及《专利审查指南》等配套规章制度的正式实施,中国药品专利期限补偿制度PTE的整体框架和思路基本确定和形成,中国医药开启新纪元。基于正式落地运转的中国药品专利补偿PTE运行机制,从药品专利布局、临床试验进展、药品申报以及上市的策略的角度来看,笔者建议,原研药厂针对已在中国境内注册上市的原研药品相关专利进行药品专利期限补偿制度PTE适用时以及仿制药厂在进行仿制药申报时均需要兼顾中国的药品专利期限补偿PTE机制,从药品开发及商业化推广、专利布局以及可能涉及的并购及药品技术交易等多角度进行综合考量:
(1) 原研药厂可根据临床试验实际进展、药品开发及商业化推广的实际情况,从化合物、盐、晶型、制剂、前药、手性、联合用药、适应症等多个角度对原研药进行专利布局保护,延长专利保护期。
(2) 一个原研药品同时存在多项专利的,药品上市许可持有人只能综合考虑并请求对其中一项专利给予药品专利权期限补偿;一项专利同时涉及多个原研药品的,药品上市许可持有人只能综合考虑并请求只能对一个药品就该专利提出药品专利权期限补偿请求;因此原研药厂需要提前布局和及时提交专利期限补偿请求,使专利期限的补偿最大化和最合理化,综合兼顾各个专利的期限、保护范围和稳定性,以及相应药品的临床试验及上市审批进度、商业化前景等因素来选择最佳的药品和专利组合并提出药品专利期限补偿申请。
(3) 核心专利适用药品专利期限补偿制度PTE后,将导致仿制药进入市场时间推后,仿制药厂应当密切关注原研药厂的专利期限补偿情况,并据此规划仿制药的药品上市项目进程和专利应对策略,同时需要兼顾考虑针对相关专利是否提起无效措施等。
(4) 此外,在相关涉及药品的投融资并购尽职调查、药品技术许可与交易(License in /out)中同样需要重点对专利有效期进行调查。由于生物医药领域专利有PTA、PTE等多种延长制度,所以专利有效期的确定通常更为困难,但很重要。如下我们列举了一个过往服务案例技术许可与交易License Agreement条款关于许可费用期限的一个条款(请见下图),其中将特定专利有效期到期、首次商业销售后满十年、以及监管独占期等较晚者作为支付许可使用费的期限。关于生物医药项目的技术许可与交易(License in/out)、法律尽职调查以及知识产权尽职调查可参考笔者往期文章《生物医药技术许可交易中的关键考量点及知识产权尽职调查与风险应对》。

总体来说,生物医药行业事关民生,新药从实验室发现到上市应用的整个过程,历经先导化合物的产生与优化、候选药物的临床前和临床试验Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期等诸多研究内容才可能完成新药创制,从而使得本身生物医药行业具有行业技术壁垒高、研发成本高、周期长、临床试验不确定、监管严格等特点。原研药亦或仿制药,不管是First-in-class,还是Me-too、Me-better、 Fast-follow、Best-in-class,随着中国药品专利补偿PTE运行机制的正式落地运转,如何更好地平衡原研药公司和仿制药公司的利益,促进生物医药行业的发展,解决专利争端,建议广大生物医药企业密切关注新《专利法实施细则》以及新《专利审查指南》的运行情况,同时关注国务院、国家知识产权局和国家药品监督管理局后续出台的相关规定,及时地调整专利保护策略和药品审批策略。
[1] FindLaw Attorney Writers. Patent Term Extensions and Restoration under the Hatch — Waxman Act [EB/OL]. (2017-07-05)https://corporate.findlaw.com/intellectual-property/patent-term-extensions-and-restoration-under-the-hatch-waxman-act.html
[2] 药品专利链接制度(Patent Linkage)旨在将仿制药上市审批程序与原研药的专利保护相链接,鼓励药品创新同时解决药品可及性,在仿制药上市前对可能的专利争端加以早期解决,从而平衡原研药公司和仿制药公司的利益,促进制药行业的发展。需要指出,美国专利链接制度仅适用于化学药,由于生物等效性评价的难度,生物药并没有被纳入Hatch-Waxman法案的框架之内,与Hatch-Waxman法案不同的生物药的原研药企业与仿制药企业之间进行专利信息交换和专利纠纷解决方案 是通过“专利舞蹈”Patent dance进行的;而中国于2021年实施的专利链接制度虽然适用于化学药、生物制品以及中药,但生物制品和中药只涉及在CDE中国上市药品专利信息登记平台(中国版橙皮书)进行登记,实际并不参与药品专利链接。
[3] United States Code Title 35——Patents-Appendix L——Patent Laws (uspto.gov):35 U.S.C. 156 Extension of patent term.
https://www.uspto.gov/web/offices/pac/mpep/mpep-9015-appx-l.html#d0e303884
35 U.S.C. 156 Extension of patent term.
(a) The term of a patent which claims a product, a method of using a product, or a method of manufacturing a product shall be extended in accordance with this section from the original expiration date of the patent, which shall include any patent term adjustment granted under section 154(b) if —...
(b) Except as provided in subsection (d)(5)(F), the rights derived from any patent the term of which is extended under this section shall during the period during which the term of the patent is extended —...
(c) The term of a patent eligible for extension under subsection (a) shall be extended by the time equal to the regulatory review period for the approved product which period occurs after the date the patent is issued, except that—...
[4]FDA Orange Book:https://www.accessdata.fda.gov/scripts/cder/ob/index.cfm
[5] (REGULATION (EC) No. 469/2009 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 6 May 2009 concerning the supplementary protection certificate for medicinal products:
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32009R0469
[6] 特許法(昭和三十四年法律第百二十一号),最終更新:令和元年法律第三号:https://www.japaneselawtranslation.go.jp/law/detail/?id=3693&vm=04&re=01
第六十七条 特許権の存続期間は、特許出願の日から二十年をもつて終了する。前項に規定する存続期間は、特許権の設定の登録が特許出願の日から起算して五年を経過した日又は出願審査の請求があつた日から起算して三年を経過した日のいずれか遅い日(以下「基準日」という。)以後にされたときは、延長登録の出願により延長することができる.....
第六十八条特許権者は、業として特許発明の実施をする権利を専有する。ただし、その特許権について専用実施権を設定したときは、専用実施権者がその特許発明の実施をする権利を専有する範囲については、この限りでない。
(第六十七条第四項の規定により存続期間が延長された場合の特許権の効力)
第六十八条の二第六十七条第四項の規定により同条第一項に規定する存続期間が延長された場合(第六十七条の五第四項において準用する第六十七条の二第五項本文の規定により延長されたものとみなされた場合を含む。)の当該特許権の効力は、その延長登録の理由となつた第六十七条第四項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない
[7] Patent Term Extensions and Supplementary Protection Certificates (SPCs) Latest developments in Japan [EB/OL].
https://aippi.org/wp content/uploads/2015/09/TSueyoshi_Speaker_Pres_Pharma_3_280814. pdf.








